基于微流循環腫瘤細胞無標記聲學分離的腫瘤術后評估
發布日期:2022-04-07
瀏覽量:714次
以下文章來源于智能仿生與微納系統 ,作者馮林實驗室
大約90%的腫瘤相關死亡可歸因于轉移瘤的復發。然而,在經過手術切除等初期治療后,直接進行化療,往往會造成過度治療,加速病發。因此,長期監測CTC動態變化并據此調整治療策略,可防止過度治療并且可以及時阻止腫瘤轉移和復發。因此,CTC檢測已成為一種新的診斷和預后的生物標志物,可為癌癥治療提供有價值的指導。
物理場與微流控的復合裝置可以大大提高單純依靠芯片微納結構對CTC進行的篩選。然而,基于這些方法獲得的CTC數據與患者預后轉移的形成很難被證實。近日,北京航空航天大學機械工程學院仿生與微納研究所馮林副教授課題組利用聲波微流控從手術切除乳腺腫瘤小鼠全血中捕獲CTCs,建立一種簡單、快速、低成本的術后評價體系,并成功預測了腫瘤轉移。
圖一 通過聲微流捕獲循環腫瘤細胞來預測腫瘤轉移
首先,研究團隊采用面投影微立體光刻3D打印技術(nanoArch S140,摩方精密)設計制造了一種微流控芯片,芯片底部分布著直徑為100μm,高度為80μm的微孔陣列。該芯片封裝在厚度為10μm的玻璃片上,通過信號發生器和放大器將信號通過壓電陶瓷片傳遞給微流控,超聲信號和微流控通道中的液體在微孔處形成聲微流。利用該聲流可以對不同粒徑的聚苯乙烯小球,腫瘤細胞,卵母細胞和綠眼蟲進行捕獲,旋轉,搬運等多種操作。其次,利用濃度已知的腫瘤細胞對該微流控裝置的捕獲效率進行評價,實驗結果顯示,該裝置的捕獲效率可達96%。再次,對手術切除腫瘤后的小鼠血液進行篩選,并根據CTC數量做出小鼠形成轉移的可能性。最后,經過長期觀察術后小鼠的轉移灶形成情況,驗證預測結果。腫瘤轉移情況與根據聲微流捕獲的CTC數量做出的預測一致。
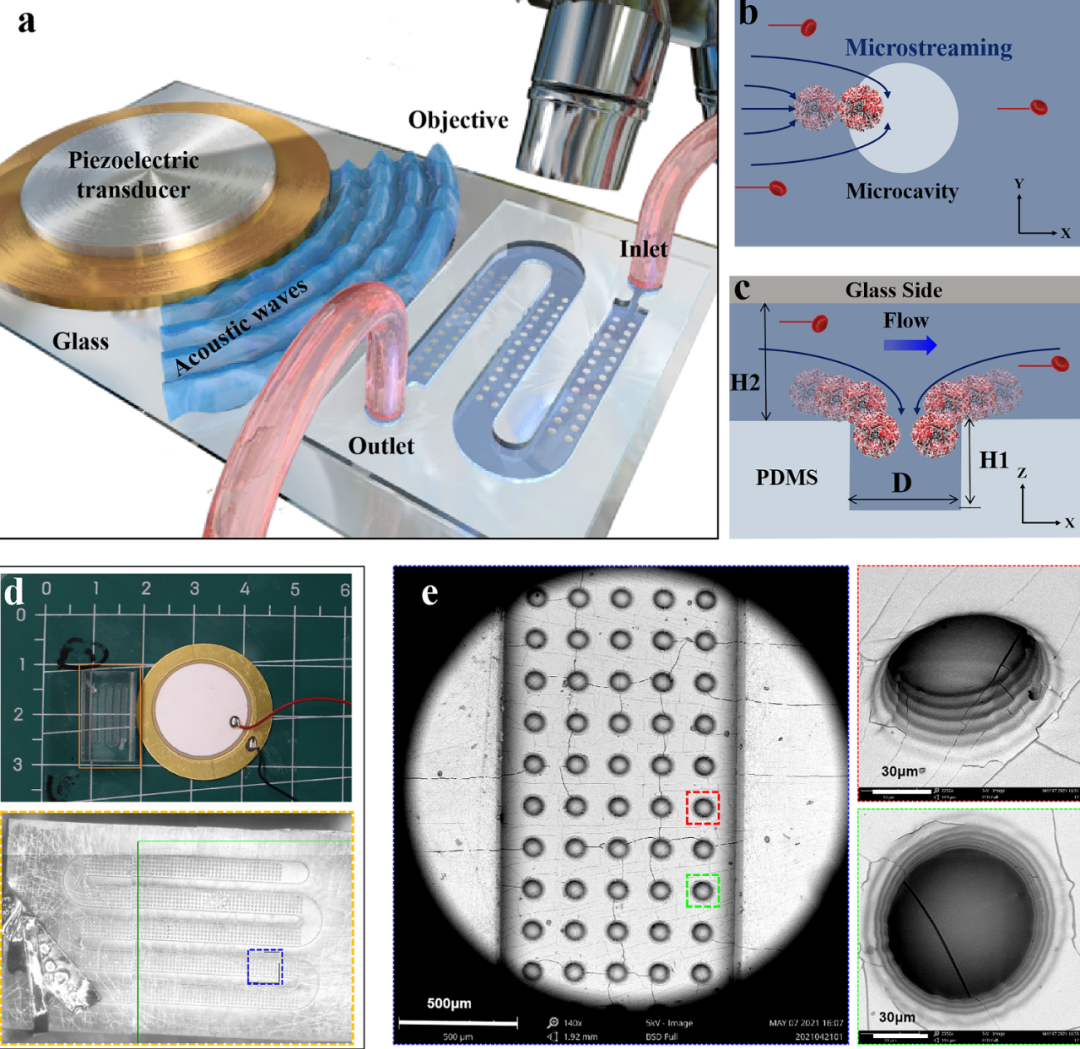
圖二 基于振蕩底微腔陣列的細胞分離聲射流裝置原理及實物圖
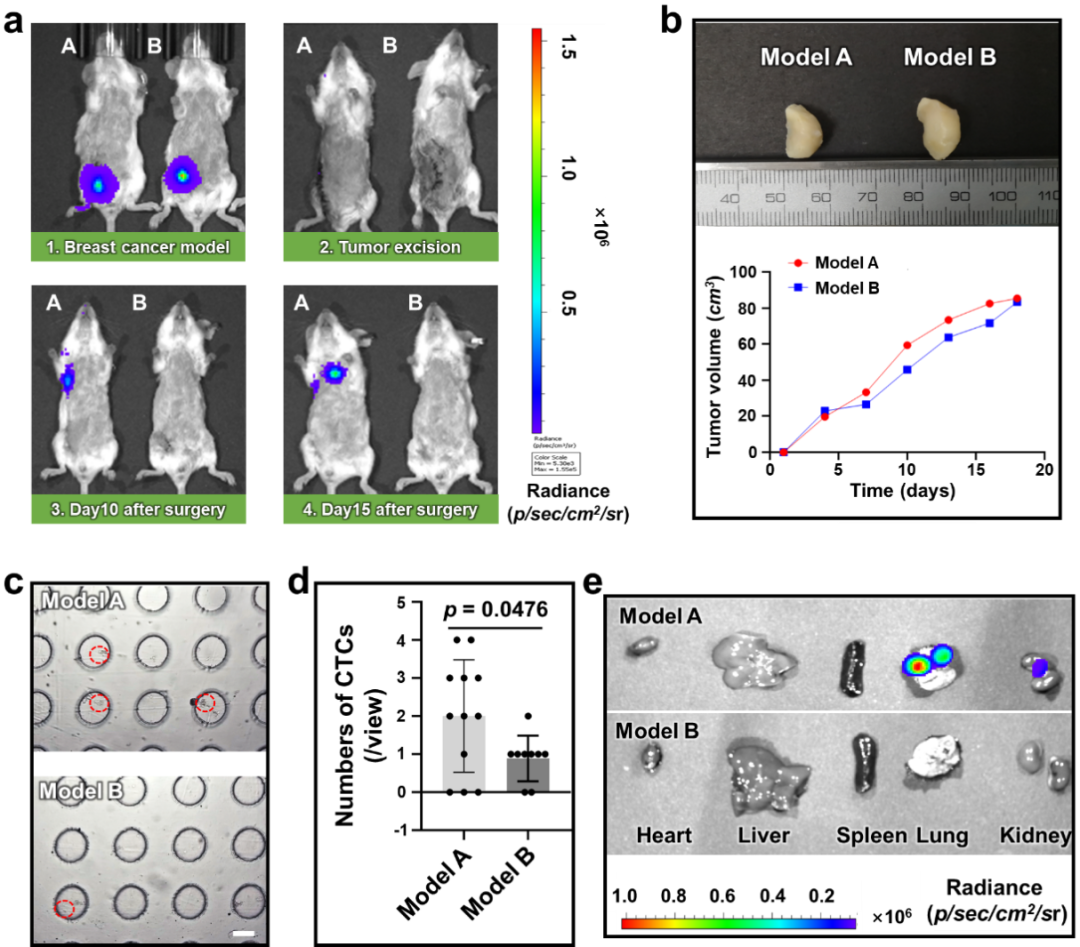
圖三 基于CTC聲流控裝置捕獲乳腺癌進行肺轉移能力的評估
該項研究成果獲得國家重點研發計劃(No.2019YFB1309700)及北京新星科技計劃項目(No. Z191100001119003)支持,以“Postoperative evaluation of tumorbased on label-free acoustic separation of circulating tumor cells bymicrostreaming ”為題發表于國際期刊《Lab on a chip》(北京航空航天大學白雪博士,宋斌碩士為共同第一作者)。